Umweltschutz: Fullerene zur Bindung von Schadstoffen
Forschern der Rice University zufolge haben behandelte Fullerene nicht nur die Fähigkeit, wertvolle, aber potentiell toxische Metalle aus Wasser und anderen Flüssigkeiten zu extrahieren, sondern können diese auch für eine mögliche spätere Nutzung speichern.
Im Labor von Chemiker Andrew Barron von der RICE University wurde entdeckt, dass hydroxilierte Carbon-60 Fullerene (sogenannte „Buckyballs“) zu Perl-ähnlichen Strängen aggregieren. Diese können in Lösung enthaltene Metalle binden oder diese separieren, wobei einige Metalle besser gebunden werden als andere. Mögliche Anwendungen dieses Prozesses umschliessen die umweltfreundliche Entfernung von Metallen aus sauren Grubenwässern, einem Abfallprodukt der Kohlenindustrie, oder aus Flüssigkeiten, welche für die hydraulische Frakturierung (Fracking) in der Öl- und Gasproduktion genutzt werden.
Barron zufolge interagieren die behandelten Fulleren in unerwarteter Weise mit Metallen unterschiedlicher Ladungen. Dies könnte es ermöglichen, spezifische Metalle aus komplexen Flüssigkeiten zu extrahieren, während andere Metalle „ignoriert“ würden.
Frühere Studien, die in Barrons Labor durchgeführt wurden, haben gezeigt, dass sich hydroxilierte Fullerene (bekannt als Fullerenole) mit anderen Ionen verbinden und unlösliche Polymere formen. Heinmann und Kollegen führten eine Reihe von Experimenten durch, um die relative Bindungsfähigkeit von Fullerenolen an verschiedenen Metallen zu überprüfen.
“Es ist grundsätzlich gut, Metalle aus dem Wasser entfernen zu können, aber bei komplexen Flüssigkeiten liegt das Problem darin, nur bestimmte Metalle herauszufiltern”, meinte Barron. „Saure Grubenwässer enthalten beispielsweise grosse Mengen an Eisen und Aluminium und kleine Mengen an Nickel, Zink und Kupfer. Wobei letztere diejenigen Metalle sind, welche eigentlich entfernt werden sollten. Eisen und Aluminium sind nicht die schlimmsten Metalle, die im Wasser landen können. Denn sie kommen auch in natürlichem Wasser vor.“
„Nachdem wir herausgefunden hatten, dass zwischen den verschiedenen Arten von Metallen Präferenzen existieren, war es unser Ziel herauszufinden, weshalb dies der Fall ist.“
Die Antwort präsentierten die Ionen. Alle getesteten Metalle waren positiv geladene Ionen mit zwei- oder dreifacher Ladung. “Normalerweise lassen sich grössere Metalle besser trennen”, erklärte Barron. Experimente bewiesen aber das Gegenteil. Zweifach positiv geladene Metalle mit kleinem Ionenradius liessen sich besser binden als grössere. Aber im Falle von dreifach positiv geladenen Ionen funktionierte das Ganze besser mit grösseren als mit kleineren.
„Das war sehr eigenartig“, beschreibt Barron. „Die Tatsache, dass diametral entgegengesetzte Tendenzen für Metalle mit zwei- und dreifacher Ladung existierten, machte das Ganze interessant. Die Resultate bedeuteten, dass es möglich sein könnte, nur diejenigen Metalle herauszufiltern, die man möchte.“
Die Experimente zeigten, dass sich Fullerenole mit einem Dutzend Metallen verbinden und diese in feste, vernetzte Polymere verwandeln. Diese 12 Metalle, sortiert nach abnehmender Effektivität, sind Zink, Kobalt, Mangan, Nickel, Lanthan, Neodym, Kadmium, Kupfer, Silber, Calcium, Eisen und Aluminium.
Die “Perl”-Referenz des Prozesses ist nicht allzu weit hergeholt. Eine der Inspirationsquellen für die Publikation war nämlich die Tatsache, dass Metallionen Vernetzungsmittel für Proteine darstellen, welche Muscheln die erstaunliche Fähigkeit geben, an nassen Felsen zu haften.
Barron erklärte weiter, dass Fullerenole als Chelatbildner agieren, welche bestimmen, wie Ionen und Moleküle Metallionen binden. Experimente mit verschiedenen Metallen haben gezeigt, dass Fullerenole diese in weniger als einer Minute binden, worauf sie dann als kombinierte Feststoffe herausgefiltert werden konnten.
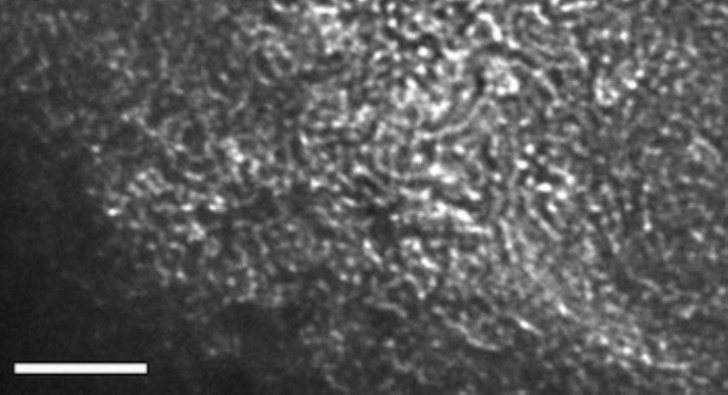
Bild: Eine Transmissionselektronenmikroskop (TEM)-Aufnahme zeigt die aggregierten „Perl-Stränge“, die sich formen, wenn sich hydroxylierte C60 Fullerene mit Metallen - in diesem Fall Eisen und Nickel - in einer Lösung vernetzten. Forscher vermuten, dass es möglich sein könnte, diese Technik für die Entfernung von bestimmten Metallmolekülen aus Lösungen zu nutzen. Die Massstableiste ist 50 Nanometer.
Bildquelle: The Barron Research Group
Quelle: Rice University